Zahlreiche Felder der Krebsforschung – vor allem die Grundlagenforschung – brauchen hochwertiges, gut annotiertes Tumormaterial. Das hat PATH. Wir stellen es Wissenschaftler*innen zur Verfügung, um die Fortschritte in der Krebsforschung zu unterstützen und zu beschleunigen.
Aufbau und Betrieb von Gewebebanken mit gutem Probenmaterial können Wissenschaftler*innen in der Regel nicht leisten. Ein zeitlich und finanziell derart aufwendiges Vorhaben können kleine Forschungs-gruppen oft nicht umsetzen. Wir von PATH möchten die Fortschritte in der Krebsforschung durch Bereitstellung dieser Infrastruktur unterstützen und beschleunigen.
Zusammen mit unseren Kooperationskliniken haben wir klar definierte Qualitätsstandards zur Verarbeitung der Proben erstellt. Alle Kooperationspartner verpflichten sich, streng nach diesen Vorschriften zu arbeiten. So können wir gewährleisten, dass das gesamte Probenmaterial von PATH einheitlich gewonnen und verarbeitet wird.
Das bei der Brust-Operation entnommene Tumorgewebe wird sofort nach der Routinediagnostik in gleiche Teile (Aliqouts) aufgeteilt und bei Temperaturen von -150°C eingefroren. Die Lagerung der Proben bei diesen sehr tiefen Temperaturen sichert eine hohe Probenqualität, wie in einer Untersuchung zur RNA-Qualität gezeigt werden konnte (Babel et al., Scientific Reports, 2020, siehe Publikationsliste).


Die Biobank der Stiftung PATH umfasst aktuell Biomaterial und Datensätze zu ca. 13.000 Brustkrebspatientinnen. Das sind insgesamt mehr als 34.000 Proben, folgender Arten:
In der PATH-Biobank sind alle molekularen Subtypen vertreten. Die Verteilung lässt sich im Kreisdiagramm ablesen. Das Tumor-Grading wurde bei älteren Proben als Surrogat-Marker für die Ki-67 Expression verwendet.
Zu allen Proben werden zudem folgende Daten in pseudonymisierter Form dokumentiert:
Eine Besonderheit des PATH-Leistungsspektrums ist die zusätzliche Erfassung von Real World Daten: Wir bitten die PATH-Frauen, die ihr Gewebe bei uns einlagern, in regelmäßigen Schreiben um krankheitsrelevante Informationen (Follow-up). Damit können wir die Patientendaten laufend aktualisieren, z.B. zum Krankheits- und Therapieverlauf.

Die PATH-Biobank ermöglicht uns, gezielt auf spezielle klinische Konstellationen zurückzugreifen – inklusive seltener Proben, die sonst kaum verfügbar sind.
Dr. Verena Thewes, Leiterin Brustkrebs Präzisionsonkologie-Studien NCT/DKFZ Heidelberg
Sind sie für Ihre Forschung an hochqualitativem Brustkrebsgewebe und annotierten Datensätzen interessiert? – Hier finden Sie unseren Forschungsantrag zum Download:

Die Unterstützung von PATH war der Schlüssel für unsere Veröffentlichung in »Cell«, und mit ihrer Hilfe haben wir mehrere Folgeprojekte in Angriff genommen.
Prof. Dr. Bernd Bodenmiller, Direktor der Quantitativen Biomedizin, Universität Zürich
PATH unterstützte seit der Gründung der Biobank mehr als 45 wissenschaftliche Projekte von universitären und öffentlichen Forschungseinrichtungen sowie der Industrie mit einer Vielzahl von Proben und Daten. Die Themenfelder sind vielfältig:
Die daraus entstandenen wissenschaftlichen Publikationen stehen hier zum Download bereit:

Die PATH Biobank zeichnet sich durch ein hohes Maß an Professionalität und Engagement aus und erweist sich als wertvoller Partner in der Forschung.
Prof. Karolina Palucka, MD, PhD, Associate Director for Cancer Immunology, Jackson Lab, USA

»Die PATH-Biobank ist für uns ein hochprofessioneller Partner in der translationalen Krebsforschung. Sie ermöglicht uns nicht nur den Zugang zu exzellent annotiertem, hochqualitativem Brustkrebs-Biomaterial, sondern auch die seltene Chance, gezielt auf spezielle klinische Konstellationen zurückzugreifen – inklusive seltener Proben, die sonst kaum verfügbar sind. Unsere Partnerschaft mit PATH ist geprägt von hoher Verlässlichkeit, wissenschaftlichem Verständnis und einem stets lösungsorientierten Austausch. Für unsere Arbeit am NCT / DKFZ Heidelberg ist diese Zusammenarbeit von unschätzbarem Wert.«
Dr. Verena Thewes, Leiterin Brustkrebs Präzisionsonkologie-Studien & Projektmanagement Brustkrebs, NCT/DKFZ Heidelberg
Deutsches Krebsforschungszentrum, Heidelberg
Prof. Dr. Peter Lichter, Dr. Verena Thewes
Ein seltenes Kollektiv von 18 fresh frozen Probenpaaren, Primärtumor und Rezidiv unter Tamoxifen (Antiöstrogen)-Therapie, wurde an die AG von Prof. Lichter vom DKFZ, Heidelberg, abgegeben. Verena Thewes konnte durch qT-PCR Messungen der Proben eine starke Expression des Enzyms BCAT1 (branched-chain amino acid transaminase 1) in antiöstrogen-resistenten Zellen zeigen. Die systematische Analyse von BCAT1 in vitro und in vivo weisen auf eine Beteiligung von BCAT1 am Wachstum von antiöstrogen-resistenten und Östrogenrezeptor-negativen Brusttumoren hin. Darüber hinaus wurde eine Assoziation zwischen hoher BCAT1 Expression und einem erhöhten Level des Proliferationsmarkers Ki-67 beobachtet, die eine pro-proliferative Rolle von BCAT1 in Brustkarzinomen suggeriert. Hohe BCAT1 Level sind mit einem verringerten relapse-free survival in Patienten unter adjuvanter Tamoxifen-Therapie und einem verringerten Gesamtüberleben assoziiert. (Thewes et al., Oncogene (2017), 1–11).

»Die von Patienten gegründete PATH-Biobank ist ein Partner, dem man wirklich vertrauen und auf den man bauen kann. PATH hat für uns die Sammlung von Brusttumorproben für die Einzelzell-analyse organisiert. Sie planten und organisierten alle Biobanking-Aktivitäten auf hochprofessionelle Weise und sorgten dafür, dass wir über viele Jahre hinweg kontinuierlich Proben von höchster Qualität sammeln konnten. PATH unter-stützte uns auch in rechtlichen Fragen und hält die Patientendaten bis heute auf dem neuesten Stand. Diese Unterstützung von PATH war der Schlüssel für unsere Veröffentlichung in Cell, und mit ihrer Hilfe haben wir mehrere Folge-projekte in Angriff genommen.«
Prof. Dr. Bernd Bodenmiller, Direktor der Abteilung für Quantitative Biomedizin; Universität Zürich, assoziierter Professor für Quantitative Biomedizin im Fachbereich Biologie; ETH Zürich, Schweiz
Bodenmiller Lab, Universität Zürich
Prof. Dr. Bernd Bodenmiller
Die Arbeitsgruppe von Prof. Dr. Bernd Bodenmiller an der Universität Zürich kooperiert seit vielen Jahren mit PATH.
Tumorzellen und assoziierte gesunde Zellen bilden Tumor-Ökosysteme, die disease progression und das Ansprechen auf die Therapie bestimmen. Um diese Ökosysteme genauer zu charakterisieren, erstellten Johanna Wagner et al. einen large-scale, single-cell Atlas von Tumor- und tumor-assoziierten Immunzellen. Zusammen mit den Klinischen Daten wurden 144 Tumorgewebeproben aller molekularer Subtypen und 50 Normalgewebeproben, größtenteils von PATH zur Verfügung gestellt, analysiert.
Die Daten ergaben eine breite phänotypische Diversität in der Zusammensetzung von Tumor- und Immunzellen in den verschiedenen Brustkrebs-Ökosystemen, u. a. phänotypische Abnormalitäten und phänotypische Dominanzen. Die Analyse des Zusammenspiels zwischen Tumor und Immunzellen ergab charakteristische Muster, die mit einer Immunsuppression und poor prognosis assoziiert sind. PD-L1+ tumor-assoziierte Makrophagen und erschöpfte T-Lymphozyten waren vermehrt in high grade ER- und ER+ Tumoren zu finden. (Wagner et al., 2019, Cell 177, 1330–1345).
BioNTech
Dr. Michael Oed und Dr. Mark Laible
An »Curls« wurden von 322 FFPE-Proben mittels RT-qPCR die mRNA-Expression von ESR1/ER, PGR/PR, ERBB2/HER2 und MKI67/Ki67 untersucht. Mit Hilfe der ausführlichen PATH-Follow-up Daten konnte eine Kaplan Meier Analyse erfolgen. Es zeigte sich, dass nach einer medianen Follow-up Zeit von 7,8 Jahren die Frauen aus der Gruppe mit „Luminal A-like“ Tumoren signifikant häufiger ein Fernmetastasen-freies Überleben berichteten, im Vergleich zu den Frauen, deren Tumoren anders eingruppiert wurden, dabei handelte es sich überwiegend um „Luminal B-like“ Tumoren.
Frauen, deren Erkrankung mittels RT-qPCR als „Luminal A-like“ eingestuft wurde, erlitten sehr viel seltener eine Fernmetastasierung im 10-Jahres Zeitraum nach der Diagnose. (Laible et al. BMC Cancer (2019) 19:694)
Epidemiologie Uniklinik Schleswig-Holstein
PD Dr. Annika Waldmann, Institut für Sozialmedizin und Epidemiologie
Epidemiologische Fragestellung: Werden ältere Frauen leitliniengerecht behandelt? – Laut S3-Leitlinie für die Diagnostik, Therapie sowie Nachsorge des Mammakarzinoms sind in die Therapieentscheidung von Arzt und Patientin Behandlungsoptionen, Nutzen sowie Risiken unter anderem in Abhängigkeit des Alters einzubeziehen. Der Frage nach altersgruppenspezifischen Unterschieden in der Therapie des Mammakarzinoms ging die Arbeitsgruppe um Annika Waldmann nach. In einer retrospektiven Analyse wurden die Follow-Up-Daten von über 3.000 Frauen mit invasivem Primärtumor ohne Fernmetastasierung untersucht. Es zeigte sich eine signifikante Altersabhängigkeit für selbstberichtete Therapiemaßnahmen. Ältere Frauen (>69 Jahre) wurden signifikant weniger häufig brusterhaltend operiert und bekamen signifikant seltener Chemo- oder Strahlentherapie und zielgerichtete Behandlungen (AHT und Trastuzumab) als Patientinnen der jüngeren Altersgruppen (<50; 50-69 Jahre). Die Gründe hierfür blieben auf Basis der vorliegenden Auswertung ungeklärt. (Peters et al., Dtsch Ärztebk Int, 2015; 112:577-84)

»PATH Biobank und Biobanken im Allgemeinen waren entscheidend für die erfolgreiche retrospektive Validierung unseres Multiplex8+ Brustkrebstests. Der Zugang zu klinischen Proben bleibt für kleine Startups aufgrund der Silos, die große Pharmaunternehmen und akademische Elitegruppen aufbauen, eine Herausforderung. Deshalb unterstützt MultiplexDX mit Begeisterung die Aufgabe von Biobanken, qualitativ hochwertige Proben mit akribisch kommentierten klinischen Daten bereitzustellen, damit ALLE wissenschaftlichen Forscher unseren gemeinsamen Kampf gegen Krebs vorantreiben können.«
Evan D. Paul, PhD, leitender wissenschaftlicher Angestellter bei MultiplexDX
MultiplexDX, Bratislava
Evan Paul, PhD, Chief Scientific Officer
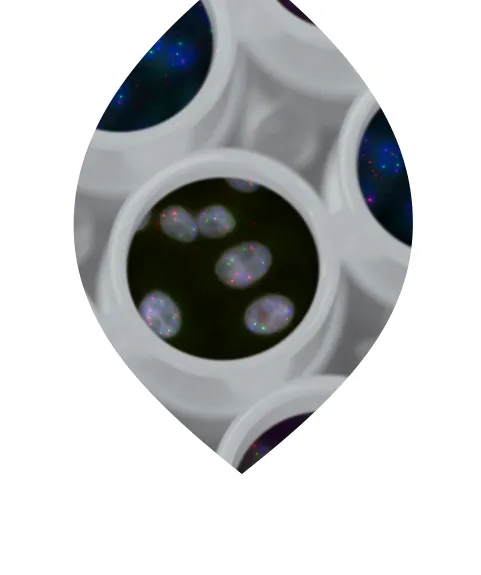
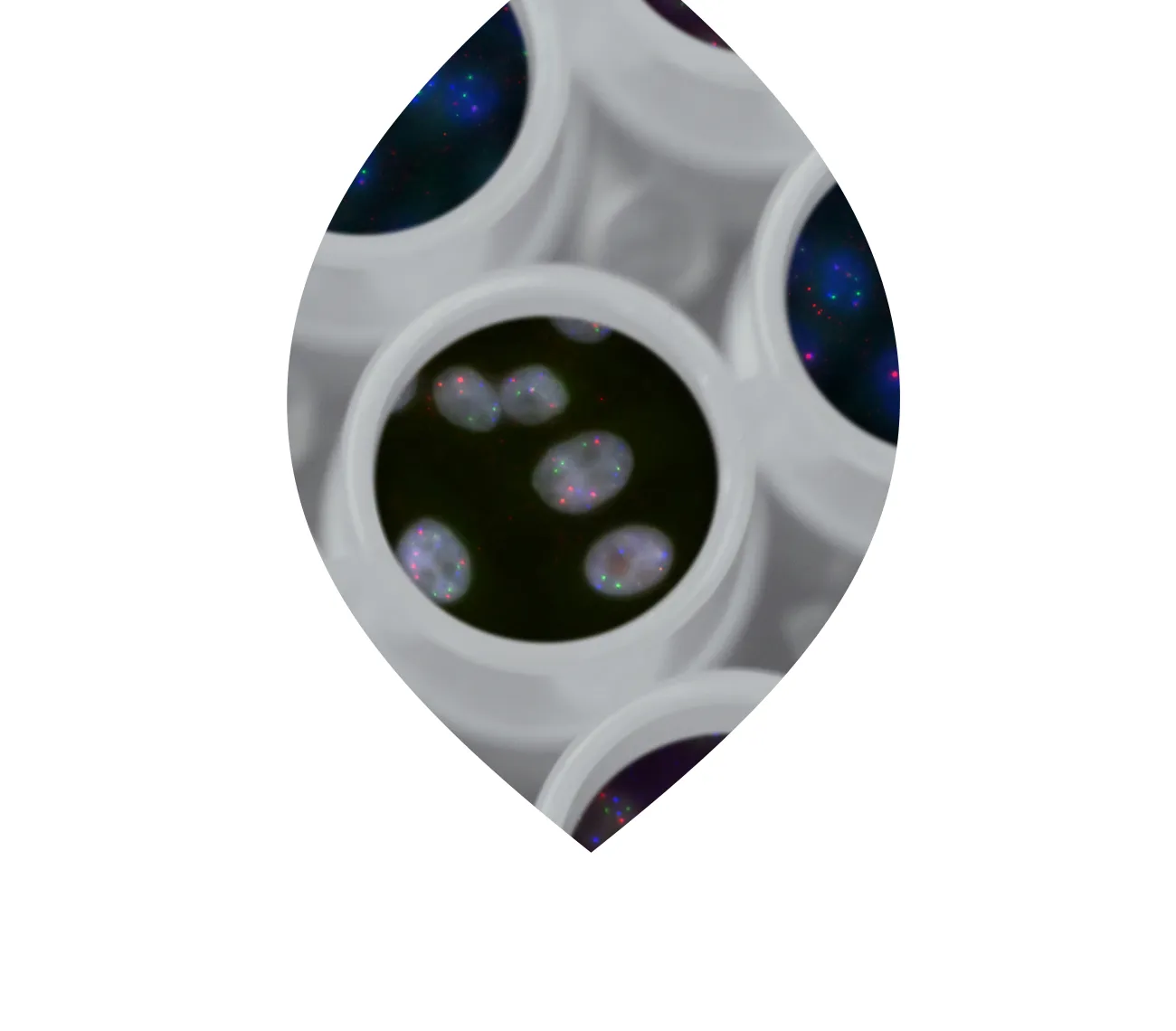
Für die Entwicklung des innovativen, prognostischen Tests Multiplex8+ wurden 715 FFPE-Proben der PATH-Biobank an die Firma MultiplexDX (Bratislava, Slowakei) abgegeben. Die zu Grunde liegende Methode mFISHseq nutzt einen bahnbrechenden Ansatz, der mehrere moderne Labortechniken kombiniert: RNA-FISH (Fluoreszenz In situ Hybridisierung) für die vier klassischen Biomarker (ESR1, PGR, HER2/ERBB2, Ki67) erfasst räumlich heterogene Biomarkerexpression und identifiziert sogenannte Regions of Interest (ROIs). Diese ROIs sind tumorreine Gewebeabschnitte, welche dann mittels Laser Capture Microdissection (LCM) gezielt entnommen werden. Für diese ROIs werden mittels RNA Sequencing umfassende Transkriptomprofile erstellt und analysiert, wobei auch gleich die kritische Herausforderung der intratumoralen Heterogenität bewältigt wird. In einer Studie zeigte mFISHseq eine Genauigkeit von 93 % im Vergleich zur IHC und identifizierte Biomarker, die das Ansprechen auf zielgerichtete Therapien, einschließlich Antikörper-Wirkstoff-Konjugaten und Immuntherapien, vorhersagen können.